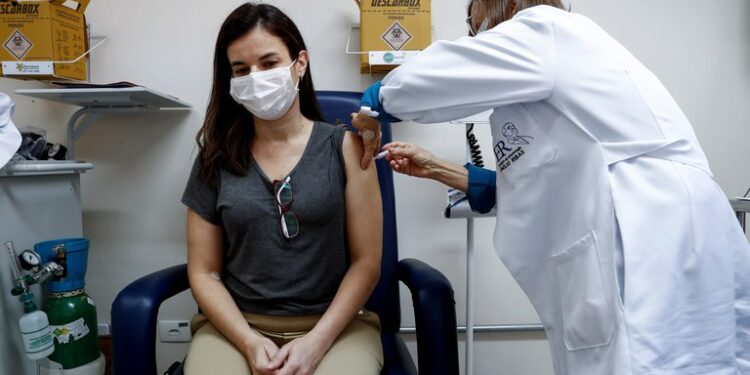
Brasil duplicará a 10.000 el número de voluntarios en la tercera fase de pruebas clínicas de la posible vacuna contra el COVID-19 desarrollada por el laboratorio anglo-sueco AstraZeneca y la universidad británica de Oxford, informó este martes el regulador sanitario brasileño.
La Agencia Nacional de Vigilancia Sanitaria (Anvisa) de Brasil señaló en un comunicado que, a pedido del laboratorio responsable de los estudios, ha autorizado la “inclusión de nuevos voluntarios”, que de esta manera pasarán de 5.000 a 10.000.
Asimismo, el órgano regulador autorizó “la ampliación del rango de edad de test de la vacuna, que ahora incluirá participantes mayores de 69 años y la adición de dos nuevos estados: Río Grande do Norte (nordeste) y Río Grande do Sul (sur)”, fronterizo con Argentina y Uruguay.
Los tests serán realizados en el Centro de Pesquisas Clínicas de Natal, capital de Río Grande do Norte, y en las universidades federales de Santa María (UFSM), en la ciudad homónima, y de Río Grande do Sul (UFRGS), en Porto Alegre.
Las pruebas de la vacuna británica fueron retomadas el lunes después de estar suspendidas durante una semana en el Reino Unido, Estados Unidos, Brasil y Sudáfrica, países donde se llevan a cabo, debido a complicaciones presentadas por uno de los voluntarios.
CAMBIOS EN EL PROTOCOLO
Brasil es uno de los países más afectados por la pandemia del nuevo coronavirus, al lado de Estados Unidos e India, con más de 4,3 millones de casos confirmados y 132.000 muertos, según el último balance oficial, divulgado el lunes por el Ministerio de Salud.
La Anvisa indicó que, en las iniciativas inmunológicas, “las solicitudes de ampliación de voluntarios y otros cambios en pruebas clínicas son comunes”.
Estos cambios “están relacionados al objetivo de la investigación, que es producir datos sólidos sobre el desempeño de cada producto y conocer mejor sus efectos en diferentes grupos poblacionales”, resaltó.
La semana pasada, apuntó el órgano regulador, fue incluido un nuevo local de fabricación para la vacuna del consorcio BioNTech (Alemania) y Wyeth/Pfizer (Estados Unidos), que cuenta con 1.000 voluntarios.
OTRAS VACUNAS
Además de la vacuna británica y la del consorcio germano-estadounidense, Anvisa ha autorizado pruebas clínicas en voluntarios de otras dos: la desarrollada por la multinacional estadounidense Johnson & Johnson (7.000 voluntarios) y la Coronavac, del laboratorio chino Sinovac (9.000).
Con los nuevos 5.000 voluntarios anunciados este martes, en total participarán del desarrollo de las cuatro vacunas 27.000 personas.
Otra vacuna, la única de origen sintético y que está siendo desarrollada por la farmacéutica estadounidense Covaxx y la red de laboratorios clínicos brasileños Dasa, espera la autorización para ser probada también en el país.
La Anvisa aclaró también que la vacuna rusa Sputnik V, por ser desarrollada totalmente fuera del país, no tendrá voluntarios y su autorización de comercialización se dará con el “registro” que se otorgará “después de cumplir con todas las exigencias”.
No obstante, la Anvisa ha realizado “reuniones de carácter preliminar y anticipando una posible demanda futura” con el gobierno regional del estado de Paraná (sur), fronterizo con Argentina y Paraguay, que estableció un acuerdo con las autoridades sanitarias rusas para la comercialización del antivirus.
El estado de Bahía (nordeste) también tiene un acuerdo con Rusia para comercializar 50 millones de dosis de esa vacuna, contemplando una futura producción de la misma, y otro similar con la estatal china Sinopharm para probar dos antivirus de ese laboratorio que están siendo desarrollados en Pekín y Wuhan.
(Con información de EFE)
Si quieres recibir en tu celular esta y otras informaciones descarga Telegram, ingresa al link https://t.me/albertorodnews y dale click a +Unirme.